Saiba o que é, quais são os gases que impactam e quando a camada de ozônio deve se regenerar
O que é a camada de ozônio? Essa é uma pergunta muito importante para quem se preocupa com a saúde do planeta Terra e, consequentemente, a nossa. Mas para respondê-la primeiro é preciso entender como funcionam alguns processos básicos da atmosfera.
Um dos principais problemas ambientais associados à química e à poluição atmosférica é a depleção (ou degradação) da camada de ozônio. Certamente você já deve ter ouvido falar desse assunto. A camada de ozônio, como o próprio nome já diz, é uma camada da atmosfera terrestre que possui elevadas concentrações de ozônio (O3). A maior concentração se situa na estratosfera, por volta de 20 km a 25 km de distância da superfície da Terra. O pico dessas concentrações se situa em altas latitudes (pólos) e as menores ocorrem nas regiões tropicais (apesar da taxa de produção de O3 ser maior nos trópicos).
Como já foi dito em nossa matéria “Ozônio: vilão ou mocinho?”, este gás pode ser tanto extremamente importante e essencial para a vida na Terra, quanto um poluente altamente tóxico. Tudo depende da camada atmosférica no qual ele se encontra. Na troposfera, é um vilão. Na estratosfera, um mocinho. Nesta matéria, vamos falar do ozônio estratosférico, apontando quais as suas funções, sua importância, como ele vem sendo degradado e como evitar que isso continue acontecendo.
Funções
O ozônio estratosférico (o mocinho) é responsável por filtrar a radiação solar em alguns comprimentos de onda (absorve toda a radiação ultravioleta B, chamada UV-B e uma parte de outros tipos de radiação) capazes de causar certos tipos de câncer, sendo um dos piores o melanoma. Ele também possui a função de manter a Terra aquecida, impedindo que todo o calor emitido sobre a superfície do planeta se dissipe.
O que é a camada de ozônio?
A camada de ozônio, como dito anteriormente é uma camada que concentra cerca de 90% das moléculas de O3. Essa camada é essencial para a vida na terra, pois protege todos os seres vivos filtrando a radiação solar ultravioleta do tipo B. O ozônio se comporta de maneira diferente de acordo com a altitude em que se encontra. Em 1930, um físico inglês chamado Sydnei Chapman descreveu os processos de produção e degradação do ozônio estratosférico com base em quatro etapas: fotólise do oxigênio; produção de ozônio; consumo de ozônio I; consumo de ozônio II.
1. Fotólise do oxigênio
A radiação solar atinge uma molécula de O2, separando seus dois átomos. Ou seja, esta primeira etapa obtém como produto dois átomos de oxigênio (O) livres.
2. Produção de ozônio
Nesta etapa, cada um dos oxigênios livres (O) produzidos na fotólise reage com uma molécula de O2, obtendo moléculas de ozônio (O3) como produto. Essa reação ocorre com a ajuda de um átomo ou molécula catalizadora, uma substância que permite que a reação ocorra mais rapidamente, porém sem atuar ativamente e sem se ligar aos reagentes (O e O2) ou ao produto (O3).
As etapas 3 e 4 demonstram como o ozônio pode ser degradado de formas diferentes:
3. Consumo de ozônio I
O ozônio formado na etapa de produção é então degradado novamente em uma molécula de O e uma de O2 pela ação da radiação solar (quando na presença de comprimentos de onda que vão de 400 nanômetros a 600 nanômetros).
4. Consumo de ozônio II
Uma outra forma do ozônio (O3) ser degradado é pela reação com átomos de oxigênio livre (O). Dessa forma, todos estes átomos de oxigênio irão se recombinar, gerando como produto duas moléculas de oxigênio (O2).
Mas então, se o ozônio é produzido e degradado, o que mantém a camada de ozônio? Para responder a essa pergunta, devemos considerar dois fatores importantes: a taxa de produção/destruição das moléculas (velocidade com que elas são produzidas e destruídas), e seu tempo de vida médio (tempo necessário para reduzir a concentração de algum composto à metade de sua concentração inicial).
Em relação à taxa de produção/destruição das moléculas, foi descoberto que as etapas 1 e 4 são mais lentas que as etapas 2 e 3 do processo. Porém, como tudo se inicia na etapa de fotólise do oxigênio (etapa 1), podemos dizer que a concentração de ozônio a ser gerada depende dela. Isso explica então por que a concentração de O3 decai em altitudes superiores a 25 km e em altitudes mais baixas; em altitudes acima de 25 km, diminui a concentração de O2. Em camadas atmosféricas mais baixas predominam comprimentos de onda maiores, que possuem menor energia para realizar a quebra das moléculas de oxigênio, reduzindo sua taxa de fotólise.
Apesar da grande descoberta destas etapas, se fôssemos considerar apenas estes processos de destruição, obteríamos valores de concentração de O3 duas vezes maiores do que os que são observados na realidade. Isso não acontece porque, além das etapas demonstradas, há ainda os ciclos não naturais de destruição do ozônio, ocasionados pelas Substancias Destruidoras da Camada de Ozônio (SDOs): os produtos como halon, tetracloreto de carbono (CTC), hidroclorofluorcabono (HCFC), clorofluorcarbono (CFC) e brometo de metila (CH3Br). Quando elas são lançadas na atmosfera, deslocam-se para a estratosfera, onde são decompostas pela radiação UV, liberando átomos livres de cloro, que por sua vez quebram a ligação do ozônio, formando monóxido de cloro e gás oxigênio. O monóxido de cloro formado reagirá novamente com os átomos livres de oxigênio, formando mais átomos de cloro, que reagirão com o oxigênio e assim por diante. Estima-se que cada átomo de cloro pode decompor cerca de 100 mil moléculas de ozônio na estratosfera e apresenta vida útil de 75 anos, porém já houve descarga suficiente para reagir por quase 100 anos com o ozônio. Além das reações com óxidos de hidrogênio (HOx) e óxidos de nitrogênio (NOx) que também reagem com o O3 estratosférico, destruindo-o, contribuindo para a degradação da camada de ozônio.
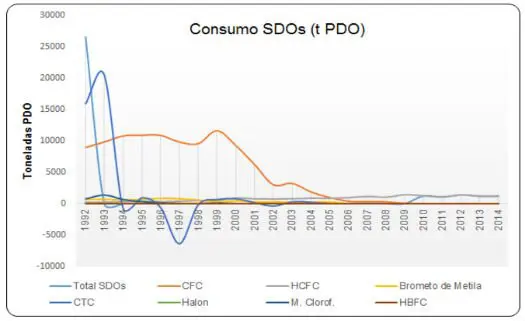
O gráfico abaixo demonstra o histórico de consumo das SDOs pelo Brasil:
Onde estão as Substâncias Destruidoras de Ozônio e como evitá-las?
CFCs
Os clorofluorcarbonos são compostos sintetizados formados por cloro, flúor e carbono, que foram muito aplicados em diversos processos -os principais estão listados abaixo:
- CFC-11: utilizado na fabricação de espumas de poliuretano como agente expansor, em aerossóis e medicamentos como propelente, na refrigeração doméstica, comercial e industrial como fluido;
- CFC-12: aplicado em todos os processos em que o CFC-11 era utilizado e também em mistura com óxido de etileno, como esterilizante;
- CFC-113: utilizado em elementos de precisão em eletrônica, como solventes para a limpeza;
- CFC-114: utilizado em aerossóis e medicamentos como propelente;
- CFC-115: utilizado como fluido na refrigeração comercial.
Estima-se que esses compostos sejam cerca de 15 mil vezes mais danosos à camada de ozônio que o CO2 (dióxido de carbono).
Em 1985, foi ratificada em 28 países a Convenção de Viena para a proteção da camada de ozônio. Com promessas de cooperação em pesquisa, monitoramento e produção de CFCs, a convenção apresentava a ideia de enfrentar um problema ambiental em nível global antes que seus efeitos fossem sentidos ou evidenciados cientificamente. Por esse motivo, a Convenção de Viena é considerada um dos maiores exemplos da aplicação do princípio da precaução em grandes negociações internacionais.
Em 1987, um grupo de 150 cientistas de quatro países foi à Antártida e confirmou que a concentração de monóxido de cloro era cerca de cem vezes superior naquela região em relação a qualquer outro lugar do planeta. Então, em 16 de setembro do mesmo ano, o Protocolo de Montreal estabeleceu a necessidade do banimento gradativo dos CFCs e sua substituição por gases que não fossem danosos à camada de ozônio. Graças a este protocolo, o dia 16 de setembro é considerado o Dia Mundial de Proteção à Camada de Ozônio.
A Convenção de Viena para a Proteção da Camada de Ozônio e o Protocolo de Montreal foram ratificados no Brasil em 19 de março de 1990, sendo promulgados no país em 6 de junho do mesmo ano, pelo Decreto n° 99.280.
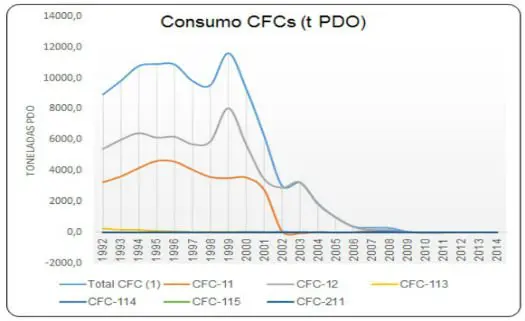
No Brasil, o uso dos CFCs foi interrompido por completo em 2010, conforme o gráfico abaixo evidencia:
HCFCs
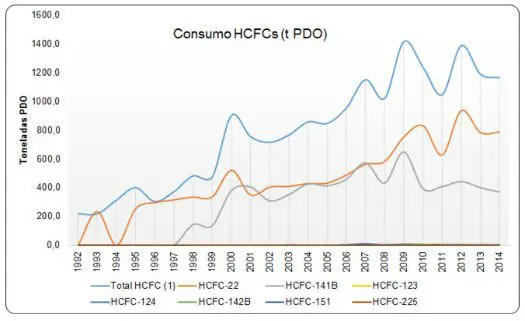
Hidroclorofluorcarbonos são substâncias artificiais importadas pelo Brasil, inicialmente, em pequenas quantidades. No entanto, devido à proibição dos CFCs, o uso está em ascensão. As principais aplicações são:
Setor de manufatura
- HCFC-22: refrigeração de ar condicionado e espumas;
- HCFC-123: extintores de incêndios;
- HCFC-141b: espumas, solventes e aerossóis;
- HCFC-142b: espumas.
Setor de Serviços
- HCFC-22: refrigeração de ar condicionado;
- HCFC-123: máquinas frigoríficas (chillers);
- HCFC- 141b: limpeza de circuitos elétricos;
- Misturas de HCFCs: refrigeradores de ar condicionado.
Brometo de metila
Trata-se de um composto orgânico halogenado que, sob pressão, é um gás liquefeito, podendo ter origem natural ou sintética. O brometo de metila é imensamente tóxico e letal aos seres vivos. Foi largamente utilizado na agricultura e na proteção de mercadorias armazenadas e para a desinfecção de depósitos e moinhos.
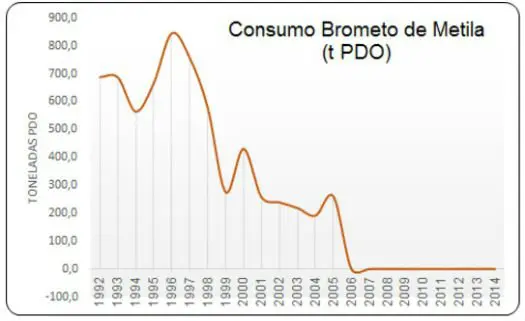
O Brasil já estava com as quantidades de importação do brometo de metila congeladas desde meados da década de 90. Em 2005, o país reduziu 30% das importações.
A tabela abaixo apresenta o cronograma estipulado pelo Brasil para a eliminação do uso do brometo de metila:
Cronograma estipulado pelo Brasil para a eliminação do uso do brometo de metila |
|
|---|---|
| Prazo | Culturas/Usos |
| 11/09/02 | Expurgos em cereais e grãos armazenados e no tratamento pós-colheita das culturas de:
|
| 31/12/04 | Fumo |
| 31/12/06 | Sementeiras de hortaliças, flores e formicida |
| 31/12/15 | Tratamento quarentenário e fitossanitário para fins de importação e exportação:
|
| Fonte: Instrução Normativa Conjunta MAPA/ANVISA/IBAMA nº. 01/2002. | |
Segundo o MMA, a utilização do brometo de metila só é autorizado para os tratamentos quarentenários e de pré-embarque reservados às importações e exportações.
Abaixo, o gráfico demonstra o histórico do consumo de brometo de metila pelo Brasil:
Halons
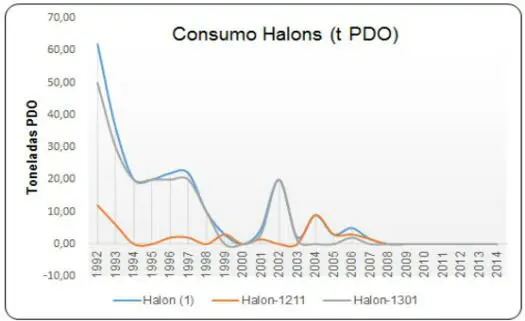
A substância halon é produzida artificialmente e importada pelo Brasil. É composta de bromo, cloro ou flúor e carbono. Esta substância foi muito utilizada em extintores para todos os tipos de incêndio. Segundo o Protocolo de Montreal, em 2002, seria permitida a importação de halon referente à média da importação brasileira entre 1995 e 1997, reduzindo 50% em 2005 e, em 2010, a importação seria totalmente proibida. Contudo, a resolução Conama n° 267, de 14 de dezembro de 2000 foi além, proibindo a importação de halons novos a partir de 2001, sendo permitido a importação apenas de halons regenerados, por não fazerem parte do cronograma de eliminação do protocolo.
O halon-1211 e o halon-1301 são usados principalmente na eliminação de incêndios marítimos, em navegação aérea, em navios petroleiros e plataformas de extração de petróleo, em acervos culturais e artísticos e em centrais geradoras de energia elétrica e nuclear, além do uso militar. Nestes casos, a utilização é permitida pela sua eficiência em apagar focos de incêndio sem deixar resíduos e sem danificar sistemas.
Segundo o gráfico abaixo, o Brasil já eliminou o consumo de halons.
Cloro
O cloro é emitido para a atmosfera de maneira antrópica (via atividade humana), principalmente através da utilização dos CFCs (clorofluorcarbonos), que já vimos acima. Eles são compostos sintéticos gasosos, muito empregados na fabricação de sprays e em geladeiras e freezers mais antigos.
Óxidos de nitrogênio
Algumas fontes emissoras naturais são transformações microbianas e descargas elétricas na atmosfera (raios). São gerados também por fontes antropogênicas. A principal delas é a queima de combustíveis fósseis a elevadas temperaturas. Por esse motivo, a emissão desses gases ocorre na troposfera, que é a camada da atmosfera onde vivemos, mas eles são carregados facilmente para a estratosfera através do mecanismo de convecção, podendo então atingir a camada de ozônio, degradando-a.
Um dos métodos para evitar as emissões de NO e NO2 é a utilização de catalisadores. Os catalisadores das indústrias e dos automóveis têm por função acelerar as reações químicas que transformam os poluentes em produtos menos prejudiciais à saúde humana e ao meio ambiente, antes que eles sejam lançados à atmosfera.
Óxidos de hidrogênio
A principal fonte dos HOx na estratosfera se constitui na formação de OH a partir da fotólise do ozônio, que produz átomos de oxigênio excitados, que reagem com vapores d’água.
Buraco da camada de ozônio
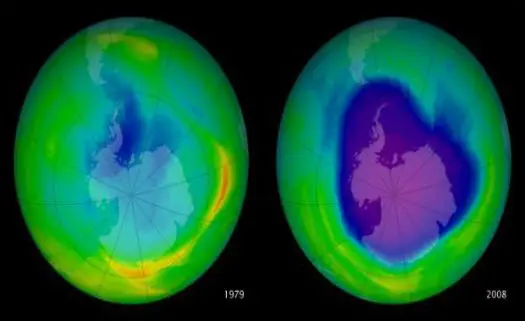
Imagem: NASA
No ano de 1985, descobriu-se que havia uma redução significativa de aproximadamente 50% do ozônio estratosférico entre os meses setembro e novembro, que corresponde ao período de primavera no hemisfério sul. A responsabilidade foi atribuída à ação do cloro proveniente dos CFCs. Diversos estudos indicaram que o processo ocorria desde 1979.
O único buraco na camada de ozônio está localizado sobre a Antártida – em qualquer outro lugar, o que ocorria era a diminuição lenta e gradual da camada de ozônio.
No entanto, há uma grande tendência atual de reversão dos danos à camada de ozônio, devido às medidas adotadas no Protocolo de Montreal, como informou o Programa das Nações Unidas para o Desenvolvimento (Pnud). A expectativa é que, por volta de 2050, a camada seja restaurada aos níveis anteriores a 1980.
Curiosidade: por que só no Polo Sul?
A explicação para o buraco só ocorrer sobre a Antártida pode ser dada pelas condições especiais do Polo Sul, como as baixa temperaturas e os sistemas isolados de circulação atmosférica.
Devido às correntes de convecção, as massas de ar circulam ininterruptamente, mas na Antártida pelo fato de seu inverno ser extremamente severo, a circulação de ar não ocorre, produzindo círculos de convecção restritos à área, que são denominados de vórtice polar ou de vórtex.
Veja também este breve vídeo produzido pelo Instituto Nacional de Pesquisas Espaciais (Inpe) sobre a degradação da camada de ozônio pelos CFCs:

Veja também:
- Ozônio como alternativa sustentável aos artigos da limpeza doméstica tradicionai
- Conheça os poluentes atmosféricos e seus efeitos
- O que é aquecimento global?
- O que são mudanças climáticas no mundo?
- O que é poluição do ar? Conheça causas e tipos
- Poluição: o que é e quais os tipos existentes
- O que é neutralização de carbono?