Pesquisadores da USP editam gene que desempenha papel-chave na eliminação de células autoagressivas
O sistema imunológico humano às vezes falha em sua função de reconhecer tecidos e órgãos como elementos próprios do corpo e passa a atacá-los como se fossem estranhos. Esse erro de identificação é denominado autoimunidade agressiva e desencadeia doenças como a síndrome poliglandular autoimune tipo 1 (APS-1) e a diabetes mellitus do tipo 1. São as temidas doenças autoimunes.
Nos últimos anos descobriu-se que dois genes, que atuam nas células da medula do timo (células mTEC), controlam a autoimunidade agressiva: o Fezf2 (sigla em inglês de forebrain-expressed zinc finger 2) e, principalmente, o Aire (sigla em inglês de autoimmune regulator).
Um grupo de pesquisadores das faculdades de Medicina (FMRP) e de Odontologia de Ribeirão Preto (FORP) da Universidade de São Paulo (USP) usou o sistema CRISPR/Cas9 – uma ferramenta de edição do DNA – para manipular o gene Aire e, dessa forma, entender melhor como ele atua no controle de doenças autoimunes.
O estudo, resultado de um projeto de pesquisa apoiado pela FAPESP e do trabalho de mestrado de Cesar Augusto Speck-Hernandez feito na FMRP-USP, foi publicado na revista Frontiers in Immunology.
“Usamos, pela primeira vez, o CRISPR/Cas9 para ‘anular’ o Aire em células mTEC de camundongos cultivadas in vitro [fora do corpo dos animais] e estudar o efeito da perda de função desse gene”, disse Geraldo Aleixo Passos, professor da FMRP e da FORP-USP e coordenador do projeto, à Agência FAPESP.
Passos explica que as doenças autoimunes são desencadeadas por autoanticorpos (que reagem contra o próprio corpo) ou pelos linfócitos T autoagressivos. Essas células, provenientes dos “timócitos”, são “educadas” na glândula do timo (um órgão torácico, situado logo à frente do coração) para não atacar os elementos próprios do corpo.
Quando essa educação falha, o timo deixa escapar para o resto do corpo linfócitos T autoagressivos que podem agredir órgãos, como a glândula suprarrenal (causando a síndrome APS-1) ou o pâncreas, onde destroem as células produtoras de insulina e provocam o surgimento da diabetes mellitus do tipo 1.
Pesquisadores da área de imunologia sempre associaram a função do gene Aire com a eliminação dos timócitos autoagressivos, pois os pacientes com a síndrome APS-1, por exemplo, apresentam mutações na sequência do DNA desse gene. Mas ainda não havia uma demonstração cabal que validasse essa associação.
“Decidimos testar a hipótese de que o gene Aire estaria envolvido na eliminação dos timócitos autoagressivos ao controlar a adesão física ou contato deles com as células mTEC. Sem o contato físico com as células mTEC, os timócitos autoagressivos não são eliminados”, disse Passos.
Edição do gene
Os pesquisadores intuíram que, se os pacientes com doenças autoimunes apresentam mutações no Aire, o gene perderia a função de controlar a adesão entre as células mTEC e os timócitos autoagressivos.
A fim de testar essa hipótese, eles usaram o CRISPR/Cas9 para romper o DNA do gene Aire de células mTEC de camundongos e provocar mutações no gene, a fim de possibilitar a perda de sua função original.
Para funcionar, um gene tem que estar íntegro, ou seja, não pode ter mutações deletérias. Quando o DNA dele é rompido por meio do CRISPR/Cas9, a célula dispara um sistema emergencial de “reparo” para reunir novamente a dupla fita antes que ela morra. Como esse sistema de reparo não é muito eficiente, a própria célula gera erros na sequência do gene-alvo, que resultam em mutação, explicou Passos.
“O gene-alvo mutante geralmente perde a sua função original e isso ocasiona algum problema na célula mutante”, disse.
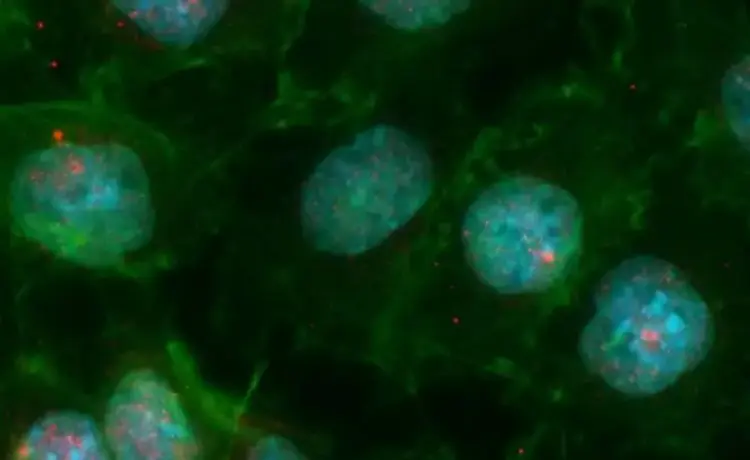
Os pesquisadores da USP observaram que as células mTEC Aire mutantes se mostraram menos capazes de aderir aos timócitos quando comparadas com as células normais, chamadas Aire selvagens.
Ao fazer o sequenciamento do transcriptoma, ou seja, do conjunto completo dos RNAs mensageiros (mRNAs, codificadores de proteínas) das células mTEC Aire mutantes e das selvagens, eles observaram que o gene Aire também controla mRNAs codificadores de proteínas envolvidas com a adesão célula-célula.
Em um estudo anterior, feito durante o trabalho de mestrado de Nicole Pezzi, sob orientação de Passos, os pesquisadores demonstraram por meio de uma técnica de silenciamento gênico, chamada RNA interferente, que o gene Aire realmente controla a adesão entre as células mTEC e os timócitos.
“Essas novas constatações reforçam a tese de que o gene Aire está implicado na adesão mTECs-timócitos, que é um processo essencial para eliminação das células autoagressivas e prevenção das doenças autoimunes”, disse Passos, pesquisador associado ao Centro de Pesquisa em Doenças Inflamatórias (CRID), um Centro de Pesquisa, Inovação e Difusão (CEPID) financiado pela FAPESP.
Na avaliação dele, a utilização da técnica CRISPR/Cas9 abre perspectivas importantes de pesquisa no sentido de “editar” o genoma das células mTEC de camundongos de laboratório de modo a “mimetizar” as mutações do gene Aire encontradas nos pacientes com doenças autoimunes.
“Isso facilitará muito as pesquisas sobre o efeito das mutações patogênicas do gene Aire. Como os genomas do homem e do camundongo são muito parecidos em termos de sequências de DNA [mais de 80% de identidade], poderemos continuar a utilizar o CRISPR/Cas9 nas células desse animal para estudar os mecanismos da autoimunidade agressiva que acontece em humanos e quem sabe, no futuro, tentar corrigi-los”, disse Passos.
Veja também:
- Oito motivos (talvez surpreendentes) para a queda de cabelo
- Anemia sideroblástica: o que é, sintomas, causas e tratamento
- Fibromialgia: saiba o que é, quais são os sintomas, causas e tratamentos naturais
- O que é artrite: sintomas e tratamentos
- Doença celíaca: sintomas, o que é, diagnóstico e tratamento