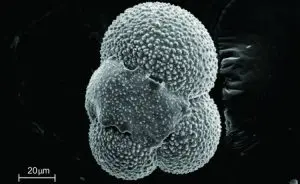
Em artigo divulgado na PLOS ONE, grupo do Centro de Pesquisa em Obesidade e Comorbidades da Unicamp descreve o impacto da alimentação hipoproteica na expressão de microRNAs associados à formação dos rins em embrião de rato
Além de nascerem com baixo peso, os filhos de mulheres submetidas a uma dieta carente de proteínas durante a gravidez tendem a apresentar problemas renais resultantes de alterações ocorridas ainda na fase embrionária, quando os órgãos estão em formação.
Em estudo publicado na revista PLOS ONE, pesquisadores da Universidade Estadual de Campinas (Unicamp) desvendaram a causa do problema em nível molecular, bem como sua relação com fenômenos epigenéticos, ou seja, com alterações na expressão gênica causadas por fatores ambientais, como estresse, exposição a toxinas ou déficit nutricional.
Segundo os autores, entre 10% e 13% da população mundial sofre de doença renal crônica – problema irreversível, progressivo e associado à hipertensão e complicações cardiovasculares.
A pesquisa é fruto do doutorado de Letícia de Barros Sene bolsista da FAPESP, e foi conduzida no Centro de Pesquisa em Obesidade e Comorbidades (OCRC), um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP.
No artigo, o grupo descreve as vias moleculares envolvidas na proliferação e na diferenciação de células renais embrionárias e fetais com base no sequenciamento de microRNas (pequenas moléculas de RNA que não codificam proteína, mas desempenham função regulatória no genoma) de filhotes de ratas que tiveram baixa ingestão de proteínas na fase gestacional.
“Sabemos que uma dieta hipoproteica na gravidez tende a acarretar, na prole, uma redução de 28% do número de néfrons, que são as estruturas renais responsáveis pelo processo de filtração do sangue. Essa sobrecarga nos néfrons gera uma série de consequências: os filhotes já começam a ficar hipertensos com apenas dez semanas de vida, quando ainda são considerados jovens”, conta Patrícia Aline Boer, pesquisadora do OCRC-Unicamp e coautora do artigo.
Programação fetal
Estudos que relacionam a saúde da gestante com o desenvolvimento dos filhos têm sido conduzidos nas últimas décadas, sobretudo em uma área de pesquisa chamada “Origens desenvolvimentistas da saúde e doença” (DOHaD, na sigla em inglês).
“Em humanos, essa relação foi observada pela primeira vez durante a chamada ‘fome holandesa’, que ocorreu na Segunda Guerra Mundial após o exército nazista cortar o suprimento de alimentos para o país. Observou-se em estudos científicos que os filhos das mulheres que passaram fome na gravidez nessa ocasião nasceram com baixo peso e desenvolveram hipertensão, alterações na resposta ao estresse, problemas cardíacos, maior propensão a diabetes e aumento da resistência insulínica”, relata Boer, que é presidente da DOHaD Brasil.
Desde então, esse fenômeno epigenético tem sido estudado de modo mais aprofundado por meio de modelos de experimentação animal. Para entender em nível molecular o que desencadeava a redução no número de néfrons, os pesquisadores do OCRC avaliaram a expressão dos microRNAs e de genes-alvo associados aos rins em néfrons ainda em formação (metanéfrons) de fetos de ratos com 17 dias de gestação.
“Sabemos que a redução do número de néfrons não é um efeito genético, mas epigenético. É provocado pelo ambiente, ou seja, o estresse da falta de proteínas altera a expressão dos genes. A sequência de DNA não muda, ocorre uma alteração na expressão de alguns genes na prole e isso, mais tarde, poderá ser transmitido de maneira hereditária para as próximas gerações. Estudamos os microRNAs por eles serem muito importantes na expressão genética e em alterações que não estão relacionadas com mudanças no DNA”, explica a pesquisadora à Agência FAPESP.
Ao comparar ratas que tiveram uma dieta regular de proteína (17%) e um grupo submetido a restrição proteica (6%) na gestação, foram identificadas 44 alterações em microRNAs – sete delas em genes associados à proliferação e diferenciação celular, essenciais para o desenvolvimento de metanéfrons.
Em seguida, os pesquisadores elencaram algumas proteínas-alvo daqueles microRNAs considerados importantes na nefrogênese. Desse modo, conseguiram demonstrar que as células dos metanéfrons, os microRNAs e as proteínas importantes para o desenvolvimento renal estão alterados na prole já no 17o. dia de gestação, o que leva à redução da proliferação e diferenciação celular precoce.
“Estudos anteriores demonstraram que, nesses casos, são formados 28% menos néfrons. No nosso estudo, identificamos que também há menos 28% de células que originam os néfrons. É a mesma proporção. Isso quer dizer que no período embrionário já deve haver alguma sinalização para a necessidade de adaptação do órgão à baixa ingestão de proteína”, conclui a pesquisadora.
Boer explica que na natureza existe uma série de exemplos desse tipo de adaptação associada à privação de nutrientes para o feto em determinada fase da gestação e que pode acarretar em alterações no desenvolvimento de órgãos. “No nosso estudo, observamos que as células-tronco [que vão se tornar néfrons] se diferenciam muito rápido. Então ocorre mais diferenciação e pouca proliferação dessas células que vão formar os néfrons”, afirma.
O artigo Impact of gestational low-protein intake on embryonic kidney microRNA expression and in nephron progenitor cells of the male fetus (doi: 10.1371/journal.pone.0246289), de Letícia de Barros Sene, Wellerson Rodrigo Scarano, Adriana Zapparoli, José Antônio Rocha Gontijo e Patrícia Aline Boer, pode ser lido em https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0246289.
Fonte: Maria Fernanda Ziegler em Agência FAPESP